Unser Mund ist die Eintrittspforte zu unseren Verdauungs- und Atemwegen. Normalerweise halten die natürlichen Abwehrkräfte des Körpers und eine gute Mundpflege das Wachstum schädlicher Bakterien unter Kontrolle. Ohne angemessene Mundhygiene können sich diese Bakterien jedoch vermehren und zu Entzündungen im Mundraum wie z.B. einer Parodontitis, führen.
Krankheiten wie Schlaganfall, Diabetes, Herz- oder Autoimmunerkrankungen können durch Mund- und Zahnfleischentzündungen begünstigt oder ihr Verlauf negativ beeinflusst werden.1 Warum diese Entzündungen bei Patient*innen mit chronisch-entzündlichen Erkrankungen besonderer Aufmerksamkeit bedürfen, wie sie deren Gesundheit beeinflussen und welche Maßnahmen die Mundhygiene verbessern können, erfahren Sie in unserem Wissenstext.
Was ist Parodontitis?
Parodontitis ist die chronische Entzündung speziell des Periodontiums, also des Zahnhalteapparates, der aus Zahnfleisch, Zement, Parodontalbandapparat und Alveolarknochen besteht.² In Abgrenzung dazu versteht man unter Gingivitis eine reversible Entzündung des Zahnfleischs.³ Gesundes Zahnfleisch haftet am Zahn. Diese Abdichtung bleibt bei einer Gingivitis intakt, während sie bei der Parodontitis durch die Entzündung zerstört wird (Abb. 1).³ Ist diese wichtige Haftung einmal verloren gegangen, kann sie in den meisten Fällen nicht erneuert werden.³ Die Zahnhälse liegen frei und es bilden sich teils tiefe Taschen, in denen die Entzündung weiter voranschreitet.³
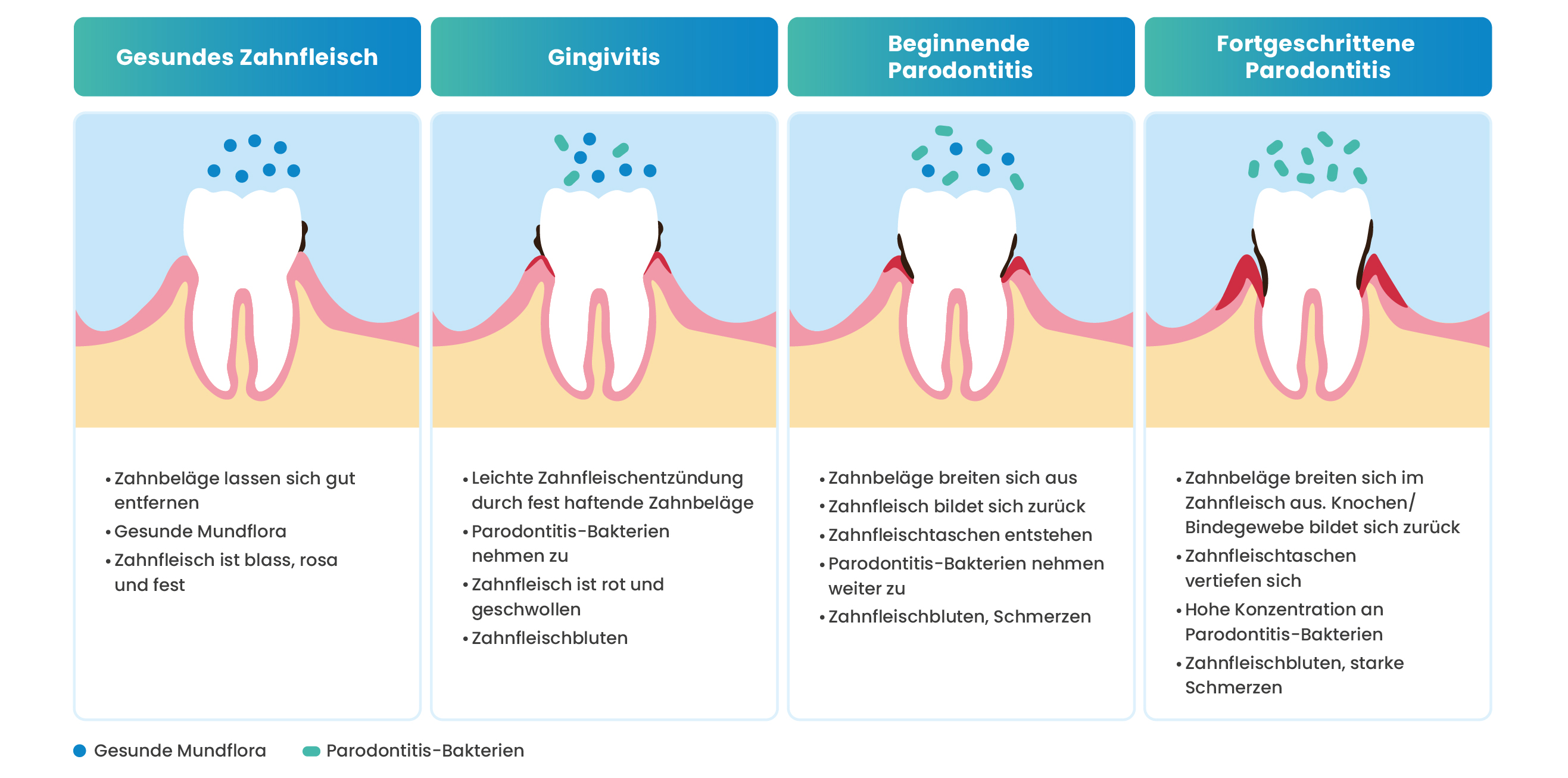
Fast 50 % der Erwachsenen in Deutschland sind von Parodontitis betroffen.³ Die Erkrankung äußert sich zunächst durch geschwollenes und gerötetes Zahnfleisch, das verstärkt zu Blutungen neigt. Häufig sind die Symptome begleitet von Mundgeruch.³ Im fortgeschrittenen Stadium kann es zur Lockerung, Verschiebung oder Verlängerung der Zähne bis hin zum Zahnverlust kommen.³
Die primäre Ursache für Parodontitis sind Bakterien.³ Die gesunde Mundhöhle hat rund 700 Arten von Bakterien, die überwiegend nützlich für uns sind. Bei mangelnder Hygiene können sich auch schädliche Bakterien ansiedeln und vermehren. Der Verlauf wird aber nicht ausschließlich durch die Bakterien bestimmt, sondern auch von der Intensität der körpereigenen Abwehr. Zusätzlich können lokale Faktoren wie die Zahnstellung und kleine Überstände nach Zahnfüllung oder -Restauration die Reinigung erschweren und so die Ansiedlung von Bakterien begünstigen. Auch systemische Risikofaktoren wie Stress, Diabetes oder Rauchen können die Entstehung von Parodontitis fördern. Bei der selteneren aggressiven Parodontitis besteht zudem eine erhebliche genetische Komponente, die den Erkrankungsfortschritt beschleunigt. Sie tritt meist bei jungen Erwachsenen auf.³
Schlechte Mundhygiene ist ein Gesundheitsrisiko
Laut der Weltgesundheitsorganisation (WHO) ist eine Verbindung zwischen der Mundgesundheit eines Menschen und seiner allgemeinen Gesundheit und Lebensqualität nachgewiesen.1 Man geht davon aus, dass sowohl orale Bakterien als auch Entzündungsmediatoren, wie der Tumornekrosefaktor (TNF), in den Kreislauf gelangen. Dort sind sie in der Lage, Mechanismen zu initiieren und aufrechtzuerhalten, die mit der Entwicklung chronischer systemischer Erkrankungen verbunden sind.²
Ein Zusammenhang zwischen Parodontitis und chronisch-entzündlichen Darmerkrankungen (CED) wurde schon vor fast 50 Jahren beschrieben.4 Die entzündlichen Vorgänge, die vom parodontalen Entzündungsherd ausgehen, können das Aufflammen der Erkrankung begünstigen und ihren Verlauf verschlechtern.5
Eine Hypothese geht davon aus, dass CED durch eine veränderte mikrobiomische Zusammensetzung der Darmflora ausgelöst werden kann.4 Chronische Entzündungen im Mundraum stehen in Zusammenhang mit einer geringeren Diversität der Darmmikrobiota und mit Darmdysbiose, einer Fehlbesiedelung des Darms mit schädlichen Bakterien, die zu Entzündungen der Darmschleimhaut führen können.4 Orale Bakterien können durch den Mund und den Magen in den Darm gelangen und sich dort vermehren.5 Bestimmte bakterielle Proteine stören die enge Verbindung zwischen den einzelnen Endothelzellen im Darm.5 Die Darmbarriere wird geschwächt und eine lokale Entzündungsreaktion begünstigt.5 Zudem ist das Immunsystem durch die orale Entzündung bereits auf diese Erreger sensibilisiert, es erkennt die Pathogene im Darm wieder und löst eine Entzündungsreaktion aus.5 So können orale Bakterien den entzündlichen Teufelskreis der CED im Darm aufrechterhalten.
Patienten mit Parodontitis neigen nachweislich vermehrt zur Entwicklung einer Psoriasis.6 Schlechte Mundhygiene scheint dabei nicht nur ein unabhängiger Risikofaktor bei der Entstehung der Erkrankung zu sein12, sondern auch die Exazerbation, also die deutliche Verschlimmerung, von psoriatischen Läsionen zu verursachen.6 Dies steht vermutlich im Zusammenhang mit der Aktivierung von T-Helferzellen und der erhöhten Ausschüttung bestimmter Interleukine, die durch die Parodontitis-Erreger und deren Produkte induziert wurden.11 Zudem scheinen strukturelle Ähnlichkeiten zwischen Bestandteilen bakterieller Zellen und körpereigener Keratinozyten dafür verantwortlich zu sein.8 In der Folge erkennt das Immunsystem nach einer initialen Immunreaktion auf die Erreger nicht nur die bakteriellen Bestandteile als körperfremd, sondern die ähnlichen körpereigenen ebenfalls.8 So wurde gezeigt, dass T-Suppressorzellen durch Bestandteile bestimmter oral-vorkommender Streptokokken aktiviert werden und eine Immunreaktion in der Haut hervorrufen können.8 Die mit der Immunreaktion verbundenen entzündlichen Prozesse treten im Krankheitsverlauf nicht nur häufiger sondern auch in verstärktem Ausmaß auf.7
Eine ursächliche Verbindung der beiden Erkrankungen stellt das angeborene Immunsystem dar, das sich als wichtig für die Pathogenese der Psoriasis sowie der Parodontitis erwiesen hat. Es können entzündliche Komponenten wie dendritische Zellen und bestimmte Rezeptoren beeinträchtigt sein, wodurch Patient*innen für Psoriasis und Parodontitis in gleicher Weise prädisponiert werden.12 Dies ist eine mögliche Erklärung dafür, dass sowohl Psoriasis-Betroffene häufiger an Parodontitis leiden als auch Patient*innen mit Parodontitis vermehrt Psoriasis entwickeln.7,12
Die Häufigkeit von rheumatoider Arthritis ist bei Patient*innen mit Parodontitis erhöht.9 Erreger im Mund können sogenannte citrullinierte Proteine generieren, Eiweiße, die die Aminosäure Citrullin enthalten.5 Diese Proteine wurden im Zusammenhang mit der rheumatoiden Arthritis beschrieben.5 Sie können bei Betroffenen die Bildung bestimmter Autoantikörper, der Anti-citrullinierte-Protein-Antikörper (ACPAs), zur Folge haben. ACPAs können das Immunsystem dazu bringen, auf körpereigene Strukturen zu reagieren und damit die Entwicklung einer rheumatoiden Arthritis begünstigen.5 Zudem können Parodontitis-Bakterien und Entzündungsmediatoren aus den entzündeten Zahnfleischtaschen in die Blutbahn gelangen und eine vermehrte Bildung von Osteoklasten auslösen. Osteoklasten sind Zellen, die für den Knochenabbau verantwortlich sind. Die verstärkte Konzentration dieser Zellen in den Gelenken kann den Krankheitsverlauf verschlechtern.5
Die Parodontitis-Erreger können nachweislich den Verlauf einer bestehenden rheumatischen Erkrankung und den Therapieerfolg negativ beeinflussen, während eine gute Mundpflege unterstützend wirken kann.9
Tabelle: Einfluss der Parodontitis bei chronisch-entzündlichen Erkrankungen

Wie kann man Parodontitis entgegenwirken?
Eine gute Mundhygiene ist essentiell, um die Entstehung und Verschlechterung einer chronischen Parodontitis zu vermeiden, wird jedoch nur von wenigen im häuslichen Umfeld erreicht.10 Viele Betroffene profitieren deshalb von einem auf sie zugeschnittenen Prophylaxeprogramm in enger Abstimmung mit dem Zahnarzt.10 Die Häufigkeit der Prophylaxetermine und das Ausmaß der Maßnahmen wird dabei entsprechend der Vorkenntnisse und Ergebnisse der häuslichen Mundhygiene individuell auf den Betroffenen eingestellt.10
Die häusliche Mundhygiene sollte in Abstimmung mit dem Zahnarzt optimiert werden, z.B. die richtige Auswahl der Zahnbürste und Zahnpasta.10 Auch zusätzliche Hilfsmittel, wie die Reinigung der Zahnzwischenräume mit Interdentalbürsten oder Zahnseide, die Anwendung eines Zungenreinigers und in speziellen Fällen auch die Unterstützung durch eine Mundspülung können in Betracht gezogen werden, auch wenn deren klinische Evidenz zur verbesserten Mundhygiene noch fehlt.10
Eine regelmäßige professionelle Zahnreinigung kann sich ebenfalls positiv auswirken.10 Patient*innen ohne Parodontitis sollten mindestens eine jährliche, für GKV-Patienten kostenlose, zahnärztliche Kontrolle wahrnehmen. Wenn Patienten unter Parodontitis leiden, sollten zuerst bakterielle Ablagerungen entfernt und die Zahnfleischtaschen gereinigt werden. So kann für optimale Hygieneverhältnisse im Mund gesorgt werden.3 In schweren Fällen können auch zahnchirurgische Eingriffe notwendig sein, um besonders tiefe Zahnfleischtaschen zu reinigen oder Zahnschäden zu reparieren.³ Patienten, die unter Parodontitis leiden oder litten, sollten zu regelmäßigen Kontrollen beim Zahnarzt angehalten werden, da eine entsprechende Nachsorge essenziell ist.³
| Zahnarztangst muss dabei heutzutage nicht mehr sein, denn viele Praxen haben sich auch auf die Behandlung ängstlicher oder schmerzempfindlicher Patienten mit modernen, schonenden Methoden eingestellt. |
- Hart J et al. Alternative & Complementary Therapies 2020; 26(5): 193-195.
- Cardoso EM et al. Postgraduate Medicine, 130:1, 98-104.
- Hierse L. IGZ Die Alternative 2015; 1: 4-10.
- Byrd KM et al. Front. Immunol 2021; 12:620124.
- Hajishengallis G et al. Nat Rev Immunol 2021; 21: 426–440.
- Macklis P et al. J Clin Aesthet Dermatol. 2020;13(6):48–53.
- Skudutyte-Rysstad R et al. BMC Oral Health 2014, 14:139.
- Johnston A et al. Clin Exp Immunol 2004; 138(1): 83–93.
- Buwembo W et al. J Dent Res Dent Clin Dent Prospect 2020; 14(1): 26-36.
- Sälzer S et al. Dtsch Zahnärztl Z 2014; 69: 608–615.
- Ungprasert G et al. J Eur Acad Dermatol Venereol. 2017 May ; 31(5): 857–862.
- Nakib S et al. Acta Odontol Scand. 2013;71(6):1423-1429.


